ধাতুবিদ্যার ৫টি চমকপ্রদ তথ্য যা তোমার পরীক্ষার প্রস্তুতি বদলে দেবে!
ভূমিকা
আমাদের চারপাশে তাকালেই কত ধাতু দেখতে পাই, তাই না? রান্নাঘরের বাসন থেকে শুরু করে বাড়ির লোহার গ্রিল, বা স্কুলের বেঞ্চ – সবকিছুতেই ধাতুর ছোঁয়া। ভৌত বিজ্ঞানের ‘ধাতুবিদ্যা’ অধ্যায়টি এই ধাতুগুলোকে নিয়েই। অনেকের কাছে এই অধ্যায়টি বেশ কঠিন মনে হয়, কারণ এতে অনেক বিক্রিয়া আর পদ্ধতি মুখস্থ করতে হয়। কিন্তু যদি মূল ধারণাগুলো পরিষ্কার থাকে, তাহলে পুরো বিষয়টি জলের মতো সোজা হয়ে যায়। চলো, আজ আমরা ধাতুবিদ্যার এমন পাঁচটি মূল ধারণা জেনে নিই, যা তোমার মাধ্যমিক পরীক্ষার প্রস্তুতিকে শুধু সহজই করবে না, বরং বিষয়টিকে মজাদার করে তুলবে।
——————————————————————————–
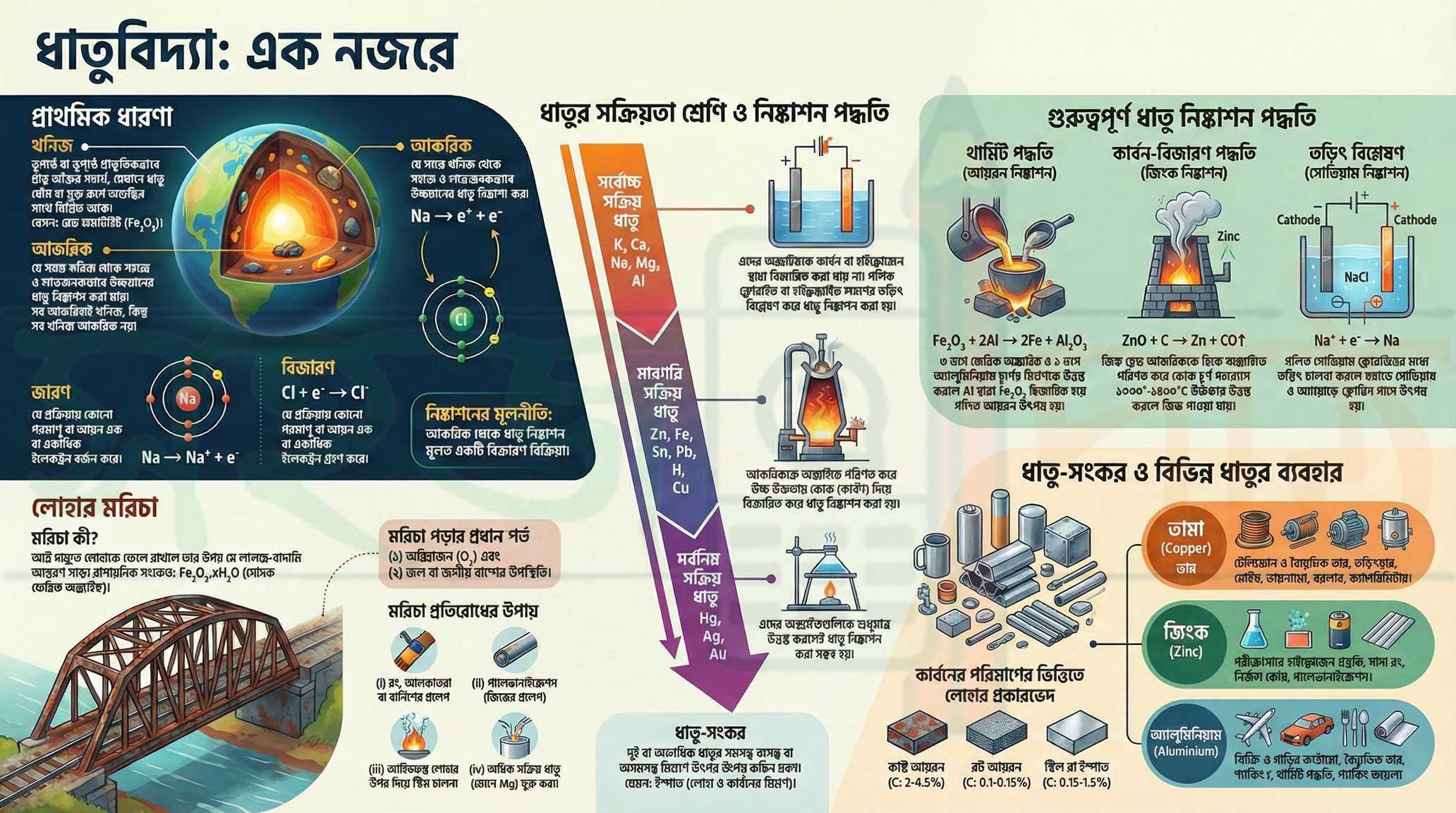
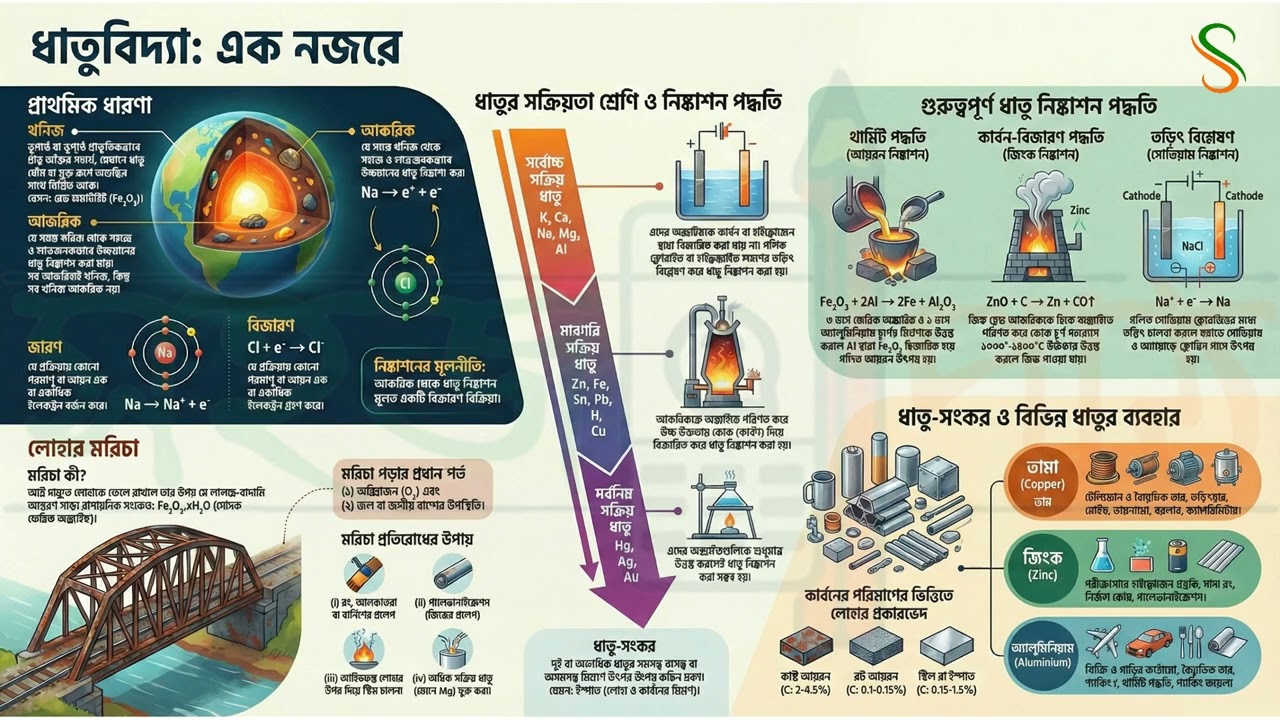
১. সব আকরিকই খনিজ, কিন্তু সব খনিজ আকরিক নয়!
ধাতুবিদ্যা বুঝতে গেলে প্রথমেই এই দুটো শব্দের পার্থক্য জানা খুব জরুরি।
খনিজ (Mineral): ভূগর্ভে বা ভূপৃষ্ঠে প্রাকৃতিকভাবে পাওয়া যায় এমন অজৈব পদার্থ, যার মধ্যে এক বা একাধিক ধাতু প্রধানত যৌগরূপে (কখনো কখনো মুক্ত অবস্থায়) অন্যান্য অশুদ্ধির সঙ্গে মিশে থাকে, তাকেই ওই ধাতুর খনিজ বলে।
আকরিক (Ore): যে সমস্ত খনিজ থেকে সহজে এবং লাভজনক উপায়ে উন্নতমানের ধাতু নিষ্কাশন করা যায়, তাদের আকরিক বলে।
পার্থক্যটা খুব সহজ। ধরো, রেড হিমাটাইট (Fe₂O₃) এবং আয়রন পাইরাইটস (FeS₂) দুটোই লোহার খনিজ। কিন্তু শুধুমাত্র রেড হিমাটাইট থেকেই সহজে ও কম খরচে লোহা বের করা সম্ভব। তাই রেড হিমাটাইট হলো লোহার আকরিক, কিন্তু আয়রন পাইরাইটস আকরিক নয়। ধাতুবিদ্যার পথে এটাই তোমার প্রথম এবং সবচেয়ে গুরুত্বপূর্ণ ধাপ।
——————————————————————————–
২. ধাতু নিষ্কাশন মানেই বিজারণ: ইলেকট্রনের এক সহজ খেলা
ধাতু নিষ্কাশনের হাজারো পদ্ধতির পেছনে লুকিয়ে আছে একটাই মূল নীতি। মনে রাখবে, ধাতুর আকরিক থেকে ধাতু নিষ্কাশন মূলত একটি বিজারণ বিক্রিয়া।
বিষয়টা আরও সহজভাবে বোঝা যাক। ইলেকট্রনীয় তত্ত্ব অনুযায়ী:
- বিজারণ (Reduction): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে, তাকে বিজারণ বলে। যেমন:
Al³⁺ + 3e⁻ → Al(অ্যালুমিনিয়াম আয়ন তিনটি ইলেকট্রন গ্রহণ করে বিশুদ্ধ অ্যালুমিনিয়াম ধাতুতে পরিণত হয়)। - জারণ (Oxidation): এর ঠিক উল্টো, অর্থাৎ যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে, তাকে জারণ বলে।
আকরিকের মধ্যে ধাতু আয়ন (ধনাত্মক চার্জযুক্ত) হিসেবে থাকে। তাকে বিশুদ্ধ ধাতুতে (চার্জবিহীন) পরিণত করতে হলে, তাকে বাইরে থেকে ইলেকট্রন গ্রহণ করতে হয়। এই ইলেকট্রন গ্রহণ করার প্রক্রিয়াটিই হলো বিজারণ। ধাতু নিষ্কাশনের সময়, ধাতব আয়ন বিজারিত হয়ে ইলেকট্রন গ্রহণ করে, আর বিজারক পদার্থটি জারিত হয়ে ইলেকট্রন বর্জন করে। এই দুটি প্রক্রিয়া একসাথেই ঘটে। অর্থাৎ, পুরো ধাতু নিষ্কাশন প্রক্রিয়াটা আসলে ধাতব আয়নকে ইলেকট্রন গ্রহণে বাধ্য করার একটা খেলা মাত্র!
——————————————————————————–
৩. সক্রিয়তা শ্রেণি: ধাতু নিষ্কাশনের মূল চাবিকাঠি
কোন ধাতুকে কোন পদ্ধতিতে নিষ্কাশন করা হবে, তার উত্তর লুকিয়ে আছে ‘ধাতুর সক্রিয়তা শ্রেণি বা তড়িৎ রাসায়নিক শ্রেণি’-তে। ধাতুগুলিকে তাদের ক্রমহ্রাসমান রাসায়নিক সক্রিয়তা অনুযায়ী ওপর থেকে নিচে পর পর সাজালে যে তালিকা পাওয়া যায়, তাকেই সক্রিয়তা শ্রেণি বলে। এই তালিকাটিই বলে দেয় কোন ধাতুর জন্য কোন বিজারণ পদ্ধতি ব্যবহার করতে হবে।
- অত্যন্ত সক্রিয় ধাতু (K, Ca, Na, Mg, Al): এরা এতটাই সক্রিয় যে এদের অক্সাইডকে কার্বন বা হাইড্রোজেন দিয়ে বিজারিত করা যায় না। এদের নিষ্কাশনের একমাত্র উপায় হলো এদের গলিত ক্লোরাইড বা হাইড্রক্সাইড লবণের তড়িৎ বিশ্লেষণ (Electrolysis) করা।
- মাঝারি সক্রিয় ধাতু (Zn, Fe, Sn, Pb, H, Cu): এই ধাতুগুলির আকরিককে প্রথমে অক্সাইডে পরিণত করা হয় এবং তারপর উচ্চ উষ্ণতায় কার্বনের মতো বিজারক পদার্থ দিয়ে বিজারিত করে ধাতু নিষ্কাশন করা হয়।
- কম সক্রিয় ধাতু (Hg, Ag, Au): এরা এতটাই কম সক্রিয় যে এদের অক্সাইডগুলিকে শুধুমাত্র উত্তপ্ত করলেই বিশুদ্ধ ধাতু পাওয়া যায়।
দেখলে তো, এই একটা শ্রেণি মনে রাখলেই পুরো অধ্যায়ের একটা পরিষ্কার ছবি তোমার মাথায় চলে আসবে।
——————————————————————————–
৪. থার্মিট পদ্ধতি: যখন এক ধাতু অন্য ধাতুকে মুক্ত করে
বিজারণ প্রক্রিয়ার একটি চমৎকার উদাহরণ হলো থার্মিট পদ্ধতি। এই পদ্ধতিতে একটি বেশি সক্রিয় ধাতু (অ্যালুমিনিয়াম) কম সক্রিয় ধাতুকে (আয়রন) তার যৌগ থেকে প্রতিস্থাপিত করে।
থার্মিট মিশ্রণ: ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) এবং ১ ভাগ অ্যালুমিনিয়াম চূর্ণের (Al) মিশ্রণকে থার্মিট মিশ্রণ বলা হয়।
এই মিশ্রণে উচ্চ উষ্ণতায় বিক্রিয়া ঘটালে অ্যালুমিনিয়াম, ফেরিক অক্সাইডকে বিজারিত করে গলিত আয়রন তৈরি করে।
বিক্রিয়া: Fe₂O₃ + 2Al → 2Fe (গলিত) + Al₂O₃
এই পদ্ধতির সবচেয়ে গুরুত্বপূর্ণ বাস্তব প্রয়োগ হলো ভাঙা রেললাইন জোড়া লাগানোর কাজে এর ব্যবহার।
——————————————————————————–
৫. মরিচা: লোহার শত্রু এবং তার প্রতিরোধের সহজ উপায়
আমরা সবাই লোহার ওপর মরিচা পড়তে দেখেছি। আর্দ্র বাতাসে লোহাকে ফেলে রাখলে এর ওপর যে লালচে-বাদামি রঙের আস্তরণ পড়ে, তাকেই মরিচা বলে।
- রাসায়নিক পরিচয়: মরিচা হলো সোদক ফেরিক অক্সাইড (Fe₂O₃ . xH₂O)।
- মরিচা পড়ার শর্ত: এর জন্য দুটি জিনিস অবশ্যই প্রয়োজন – (i) অক্সিজেন এবং (ii) জল বা জলীয় বাষ্পের উপস্থিতি।
এই শত্রুর হাত থেকে লোহাকে বাঁচানোর কিছু সহজ উপায় আছে:
- লোহার তৈরি জিনিসের ওপর আলকাতরা, রং বা বার্নিশের প্রলেপ দেওয়া।
- লোহিততপ্ত লোহার ওপর দিয়ে স্টিম চালনা করে ফেরোসোফেরিক অক্সাইডের একটি প্রতিরোধী আস্তরণ তৈরি করা।
- গ্যালভানাইজেশন (Galvanization): লোহার জিনিসের ওপর গলিত জিঙ্ক (দস্তা)-এর প্রলেপ দেওয়া। এটি মরিচা প্রতিরোধের অন্যতম সেরা উপায়।
- লোহা বা লোহা-নির্মিত বস্তুর সঙ্গে ম্যাগনেসিয়াম (Mg) ব্লক-কে অন্তরীত পরিবাহী তার দ্বারা সংযুক্ত করে মরিচা পড়া প্রতিরোধ করা যায়।
——————————————————————————–
শেষ কথা
আশা করি, এই পাঁচটি তথ্য পড়ার পর ‘ধাতুবিদ্যা’ অধ্যায়টি তোমার কাছে আর কঠিন মনে হবে না। বিষয়টি কেবল মুখস্থ করার নয়, বরং এর পেছনের যুক্তিগুলো বোঝার। বিজারণের ধারণা আর সক্রিয়তা শ্রেণির কাঠামো বুঝতে পারলেই তুমি যেকোনো ধাতুর নিষ্কাশন পদ্ধতি ব্যাখ্যা করতে পারবে।
এখন থেকে যখনই কোনো লোহার গ্রিল বা অ্যালুমিনিয়ামের বাসন দেখবে, তুমি কি তার নিষ্কাশন পদ্ধতি বা মরিচা প্রতিরোধের উপায় নিয়ে ভাববে?
ধাতুবিদ্যা: দশম শ্রেণীর জন্য একটি বিশদ পর্যালোচনা
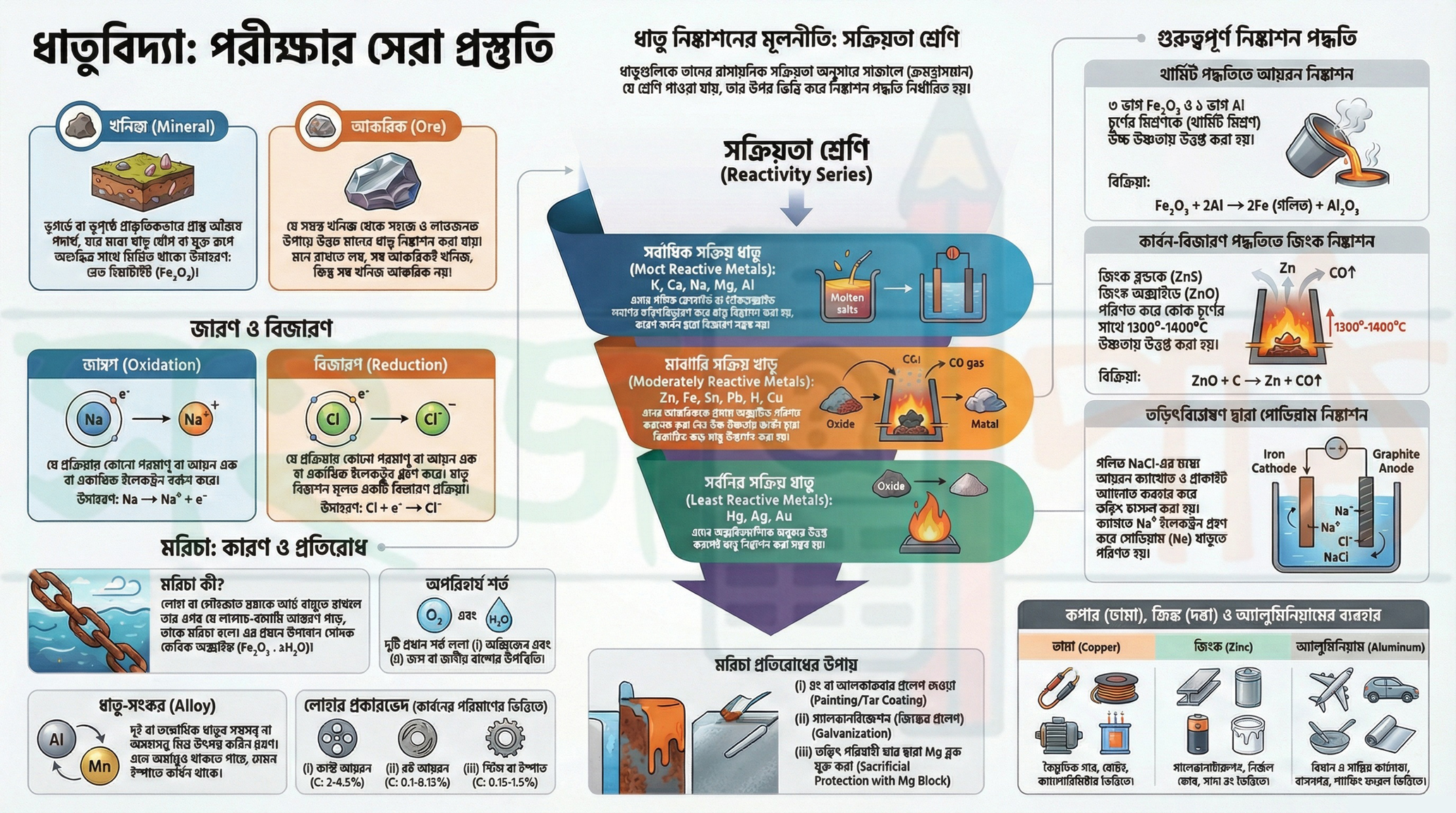
1.0 মৌলিক ধারণা (Fundamental Concepts)
ধাতুবিদ্যা বোঝার প্রথম ধাপ হলো এর মৌলিক পরিভাষাগুলি সম্পর্কে স্বচ্ছ ধারণা অর্জন করা। খনিজ, আকরিক, জারণ এবং বিজারণের মতো বিষয়গুলি ধাতু নিষ্কাশনের প্রতিটি প্রক্রিয়ার মূল ভিত্তি হিসেবে কাজ করে।
1.1 খনিজ ও আকরিক (Minerals and Ores)
খনিজ (Mineral): ভূগর্ভে বা ভূপৃষ্ঠে প্রাকৃতিকভাবে প্রাপ্ত অজৈব পদার্থ, যার মধ্যে এক বা একাধিক ধাতু প্রধানত যৌগরূপে (কখনও কখনও মুক্ত অবস্থায়) অন্যান্য অশুদ্ধির সাথে মিশ্রিত অবস্থায় থাকে, তাদের সংশ্লিষ্ট ধাতুর খনিজ বলা হয়। উদাহরণস্বরূপ, রেড হিমাটাইট (Fe₂O₃) এবং আয়রন পাইরাইটস (FeS₂) উভয়ই লোহার খনিজ।
আকরিক (Ore): যে সমস্ত খনিজ থেকে সহজে এবং লাভজনক উপায়ে উন্নত মানের ধাতু নিষ্কাশন করা যায়, তাদের আকরিক বলা হয়।
এই দুটি সংজ্ঞার মধ্যে মূল পার্থক্যটি অর্থনৈতিক এবং প্রযুক্তিগত সুবিধার উপর নির্ভরশীল। উদাহরণস্বরূপ, রেড হিমাটাইট (Fe₂O₃) থেকে লাভজনকভাবে লোহা নিষ্কাশন করা সম্ভব, তাই এটি লোহার একটি আকরিক। অন্যদিকে, আয়রন পাইরাইটস (FeS₂) থেকেও লোহা পাওয়া গেলেও, সেই প্রক্রিয়াটি জটিল এবং অর্থনৈতিকভাবে লাভজনক নয়। একারণে আয়রন পাইরাইটস লোহার খনিজ হলেও, এটিকে আকরিক হিসেবে গণ্য করা হয় না।
1.2 জারণ ও বিজারণের ইলেক্ট্রনীয় তত্ত্ব (Electronic Theory of Oxidation and Reduction)
জারণ (Oxidation): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে, তাকে জারণ বলে। Na → Na⁺ + e⁻ Ca → Ca²⁺ + 2e⁻ Fe²⁺ → Fe³⁺ + e⁻
বিজারণ (Reduction): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে, তাকে বিজারণ বলে। Cl + e⁻ → Cl⁻ O + 2e⁻ → O²⁻
ধাতুবিদ্যায় এই জারণ-বিজারণ নীতির প্রয়োগ কোনো ধাতুর রাসায়নিক সক্রিয়তার উপর নির্ভর করে, যা পরবর্তী বিভাগে আলোচনা করা হয়েছে।
2.0 ধাতু নিষ্কাশনের মূলনীতি: সক্রিয়তা শ্রেণী (Principle of Metal Extraction: The Activity Series)
ধাতুর আকরিক থেকে ধাতু নিষ্কাশন মূলত একটি রাসায়নিক বিজারণ প্রক্রিয়া। তবে, কোন ক্ষেত্রে কোন ধরনের বিজারণ কৌশল অবলম্বন করা হবে, তা মূলত নির্ভর করে ধাতুর রাসায়নিক সক্রিয়তার উপর। এই সক্রিয়তাকে নিয়মতান্ত্রিকভাবে ধাতুর সক্রিয়তা শ্রেণীতে সাজানো হয়।
ধাতুর সক্রিয়তা শ্রেণী (Metal Activity Series): ধাতুগুলিকে তাদের ক্রমহ্রাসমান রাসায়নিক সক্রিয়তা অনুযায়ী সাজালে যে সারি পাওয়া যায়, তাকে ধাতুর সক্রিয়তা শ্রেণী বা তড়িৎ-রাসায়নিক শ্রেণী বলা হয়।
বিভিন্ন ধাতুর নিষ্কাশন পদ্ধতি তাদের সক্রিয়তার স্তরের উপর কীভাবে নির্ভর করে, তা নীচের সারণিতে দেখানো হলো:
|
সক্রিয়তা স্তর (Reactivity Level) |
ধাতুসমূহ (Metals) |
নিষ্কাশন পদ্ধতি (Extraction Method) |
|
অধিক সক্রিয় |
K, Ca, Na, Mg, Al |
এই ধাতুগুলির গলিত ক্লোরাইড বা হাইড্রক্সাইড লবণের তড়িৎবিশ্লেষণ করে নিষ্কাশন করা হয়, কারণ এদের অক্সাইড হাইড্রোজেন বা কার্বন দ্বারা বিজারিত হয় না। |
|
মাঝারি সক্রিয় |
Zn, Fe, Sn, Pb, H, Cu |
এই ধাতুগুলির আকরিককে প্রথমে অক্সাইডে পরিণত করা হয় এবং তারপর উচ্চ উষ্ণতায় বিজারিত করে ধাতু নিষ্কাশন করা হয়। |
|
কম সক্রিয় |
Hg, Ag, Au |
সাধারণত এই ধাতুগুলির অক্সাইডগুলিকে শুধুমাত্র উত্তপ্ত করেই ধাতু নিষ্কাশন করা সম্ভব হয়। |
পরবর্তী বিভাগে এই নিষ্কাশন পদ্ধতিগুলির কয়েকটি নির্দিষ্ট উদাহরণ এবং তাদের প্রায়োগিক দিক নিয়ে আলোচনা করা হবে।
3.0 নির্দিষ্ট ধাতু নিষ্কাশন পদ্ধতি (Specific Metal Extraction Methods)
এই বিভাগে পূর্বে আলোচিত নীতিগুলির বাস্তব প্রয়োগ তুলে ধরা হবে। লোহা, জিঙ্ক এবং সোডিয়ামের মতো গুরুত্বপূর্ণ ধাতু নিষ্কাশনের জন্য ব্যবহৃত তিনটি স্বতন্ত্র শিল্প প্রক্রিয়া এখানে বিশদভাবে বর্ণনা করা হয়েছে।
3.1 থার্মিট পদ্ধতিতে আয়রন নিষ্কাশন (Iron Extraction by Thermite Process)
- থার্মিট মিশ্রণ (Thermite Mixture): ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) এবং ১ ভাগ অ্যালুমিনিয়াম (Al) চূর্ণের মিশ্রণকে থার্মিট মিশ্রণ বলা হয়।
- উচ্চ উষ্ণতায় এই মিশ্রণকে উত্তপ্ত করলে অ্যালুমিনিয়াম দ্বারা ফেরিক অক্সাইড বিজারিত হয়ে গলিত লোহা উৎপন্ন করে। এই বিক্রিয়াটি অত্যন্ত তাপ উৎপাদক।
Fe₂O₃ + 2Al → 2Fe (গলিত) + Al₂O₃ - এই পদ্ধতির একটি গুরুত্বপূর্ণ ব্যবহার হলো ভাঙা রেললাইন জোড়া লাগানোর কাজে, যেখানে গলিত লোহা দুটি ভাঙা অংশকে ঝালাই করতে ব্যবহৃত হয়।
3.2 কার্বন-বিজারণ পদ্ধতিতে জিঙ্ক নিষ্কাশন (Zinc Extraction by Carbon-Reduction Process)
জিঙ্ক নিষ্কাশন প্রক্রিয়াটি কয়েকটি ধাপে সম্পন্ন হয়। প্রথমে, জিঙ্ক ব্লেন্ড (ZnS) নামক আকরিককে নিয়ন্ত্রিত বায়ুপ্রবাহে জারিত করে জিঙ্ক অক্সাইডে (ZnO) পরিণত করা হয়। এরপর, প্রাপ্ত জিঙ্ক অক্সাইডের সাথে কোক চূর্ণ (কার্বন) বিজারক হিসেবে মিশিয়ে প্রায় ১৩০০°-১৪০০°C উষ্ণতায় উত্তপ্ত করা হয়। এর ফলে জিঙ্ক অক্সাইড ধাতব জিঙ্কে বিজারিত হয়।
চূড়ান্ত বিজারণ বিক্রিয়াটি নিম্নরূপ: ZnO + C → Zn + CO↑
3.3 তড়িৎবিশ্লেষণ দ্বারা সোডিয়াম নিষ্কাশন (Sodium Extraction by Electrolysis)
সোডিয়ামের মতো অত্যন্ত সক্রিয় ধাতু নিষ্কাশনের জন্য তড়িৎবিশ্লেষণ পদ্ধতি ব্যবহার করা হয়। এই প্রক্রিয়ায়, একটি পাত্রে গলিত সোডিয়াম ক্লোরাইড (NaCl) তড়িৎবিশ্লেষ্য হিসেবে নেওয়া হয় এবং এতে একটি আয়রন ক্যাথোড ও একটি গ্রাফাইট অ্যানোড ব্যবহার করা হয়।
গলিত NaCl-এর বিয়োজন: NaCl → Na⁺ + Cl⁻
তড়িৎ চালনা করলে ক্যাথোডে ও অ্যানোডে নিম্নলিখিত বিক্রিয়াগুলি ঘটে:
ক্যাথোড বিক্রিয়া (Cathode Reaction): Na⁺ + e⁻ → Na অ্যানোড বিক্রিয়া (Anode Reaction): Cl⁻ → Cl + e⁻, এবং Cl + Cl → Cl₂
ধাতু নিষ্কাশনের পর সবচেয়ে বড় চ্যালেঞ্জ হলো এর গুণমান বজায় রাখা। পরবর্তী অংশে লোহার ক্ষয় বা মরচে এবং তা প্রতিরোধের উপায় নিয়ে আলোচনা করা হয়েছে।
4.0 লোহার ক্ষয়: মরচে (Corrosion of Iron: Rust)
লোহার ক্ষয়, যা সাধারণত মরচে নামে পরিচিত, একটি গুরুতর অর্থনৈতিক এবং কাঠামোগত সমস্যা। এই বিভাগে মরচের সংজ্ঞা, এর গঠনের জন্য প্রয়োজনীয় শর্তাবলী এবং এটি প্রতিরোধের প্রধান পদ্ধতিগুলি নিয়ে আলোচনা করা হবে।
4.1 মরচে: সংজ্ঞা ও শর্ত (Rust: Definition and Conditions)
সংজ্ঞা: লোহা বা লোহাজাত দ্রব্যকে আর্দ্র বায়ুতে খোলা অবস্থায় রেখে দিলে তার ওপর যে লালচে-বাদামি বর্ণের আস্তরণ পড়ে, তাকে মরচে (Rust) বলে।
রাসায়নিক সংকেত: মরচের কোনো নির্দিষ্ট রাসায়নিক সংযুতি নেই। এর প্রধান উপাদান হলো সোদক ফেরিক অক্সাইড, যার সাধারণ সংকেত Fe₂O₃ . xH₂O।
মরচে পড়ার জন্য দুটি শর্ত অপরিহার্য:
- অক্সিজেনের উপস্থিতি
- জল অথবা জলীয় বাষ্পের উপস্থিতি
4.2 মরচে পড়ার হার বৃদ্ধিকারী কারণসমূহ (Factors that Accelerate Rusting)
কিছু নির্দিষ্ট কারণ মরচে পড়ার হারকে ত্বরান্বিত করতে পারে। এগুলি হলো:
- আধানযুক্ত কণার উপস্থিতি (যেমন: Cl⁻, SO₄²⁻)।
- বায়ুতে জলীয় বাষ্পের পরিমাণ বৃদ্ধি।
- উষ্ণতা বৃদ্ধি।
4.3 মরচে নিবারণের উপায় (Methods of Rust Prevention)
মরচে প্রতিরোধের জন্য বিভিন্ন কার্যকরী পদ্ধতি রয়েছে, যার মধ্যে চারটি প্রধান উপায় নিচে বর্ণনা করা হলো:
- প্রলেপন (Coating): লোহাজাত বস্তুর উপর আলকাতরা, রং বা বার্নিশের মতো প্রতিরক্ষামূলক আস্তরণ প্রয়োগ করা হয়, যা বায়ুমণ্ডলের সংস্পর্শে আসতে বাধা দেয়।
- পৃষ্ঠতলের পরিবর্তন (Surface Treatment): লোহিততপ্ত লোহার ওপর দিয়ে স্টিম চালনা করলে লোহার পৃষ্ঠতলে ফেরোসোফেরিক অক্সাইডের একটি স্থায়ী আস্তরণ তৈরি হয়। এই আস্তরণটি লোহাকে জল ও বায়ুর সংস্পর্শ থেকে রক্ষা করে।
- গ্যালভানাইজেশন (Galvanization): লোহাজাত দ্রব্যের উপর গলিত জিঙ্কের প্রলেপ দেওয়ার প্রক্রিয়াকে গ্যালভানাইজেশন বলা হয়। জিঙ্ক লোহার চেয়ে বেশি সক্রিয় হওয়ায় এটি আগে জারিত হয় এবং লোহাকে সুরক্ষিত রাখে।
- সংরক্ষণমূলক সুরক্ষা (Sacrificial Protection): লোহা বা লোহাজাত বস্তুর সাথে পরিবাহী তারের মাধ্যমে ম্যাগনেসিয়াম (Mg) -এর মতো অধিক সক্রিয় ধাতুর একটি ব্লক যুক্ত করা হয়। এই ব্যবস্থায়, অধিক সক্রিয় ধাতুটি আগে ক্ষয়প্রাপ্ত হয় এবং লোহাকে সুরক্ষিত রাখে।
ধাতুর ক্ষয় রোধ করার পাশাপাশি, ধাতুর বৈশিষ্ট্য উন্নত করার জন্য ধাতু-সংকর তৈরি করা হয়, যা পরবর্তী বিভাগে আলোচিত হয়েছে।
5.0 ধাতু-সংকর ও বিভিন্ন ধাতুর ব্যবহার (Alloys and Uses of Various Metals)
বিশুদ্ধ ধাতুগুলির বৈশিষ্ট্য উন্নত করতে বা নতুন বৈশিষ্ট্য যোগ করতে প্রায়শই সেগুলিকে অন্য ধাতু বা অধাতুর সাথে মেশানো হয়, যা ধাতু-সংকর বা অ্যালয় নামে পরিচিত। এই চূড়ান্ত বিভাগে ধাতু-সংকরের সংজ্ঞা এবং লোহা, তামা, দস্তা ও অ্যালুমিনিয়ামের মতো গুরুত্বপূর্ণ শিল্প ধাতুর ব্যবহার আলোচনা করা হয়েছে।
5.1 ধাতু-সংকর (Alloys)
দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণে উৎপন্ন কঠিন দ্রবণকে ধাতু-সংকর (Alloy) বলে। তবে ধাতু-সংকরে অধাতুও থাকতে পারে। এর একটি প্রধান উদাহরণ হলো ইস্পাত, যা মূলত লোহা এবং কার্বনের একটি ধাতু-সংকর।
5.2 আয়রনের প্রকারভেদ (Types of Iron)
কার্বনের পরিমাণের উপর ভিত্তি করে লোহাকে প্রধানত তিনটি শ্রেণীতে ভাগ করা যায়:
- কাস্ট আয়রন বা ঢালাই লোহা: ২-৪.৫% কার্বন
- রট আয়রন বা পেটা লোহা: ০.১-০.১৫% কার্বন
- স্টিল বা ইস্পাত: ০.১৫-১.৫% কার্বন
5.3 তামা, দস্তা, ও অ্যালুমিনিয়ামের ব্যবহার (Uses of Copper, Zinc, and Aluminium)
তামার ব্যবহার (Uses of Copper)
- টেলিফোনের তার এবং বৈদ্যুতিক ওয়্যারিং-এর তার হিসেবে।
- তড়িৎকোষে তড়িৎদ্বাররূপে এবং তড়িৎ-লেপনের কাজে।
- মোটর, ট্রান্সফরমার ও ডায়নামোর মতো বৈদ্যুতিক যন্ত্র তৈরিতে।
- বয়লার ও ক্যালোরিমিটার তৈরিতে।
দস্তার ব্যবহার (Uses of Zinc)
- পরীক্ষাগারে হাইড্রোজেন গ্যাস প্রস্তুতিতে।
- “জিঙ্ক হোয়াইট” নামক সাদা রং প্রস্তুতিতে।
- শুকনো বা নির্জল কোষ তৈরিতে।
- লোহাকে মরচের হাত থেকে রক্ষা করতে গ্যালভানাইজেশন প্রক্রিয়ায়।
অ্যালুমিনিয়ামের ব্যবহার (Uses of Aluminium)
- বিমান এবং মোটরগাড়ির কাঠামো তৈরিতে।
- বৈদ্যুতিক তার প্রস্তুতিতে।
- রান্নার বাসনপত্র তৈরিতে।
- থার্মিট পদ্ধতিতে ভাঙা রেললাইন জোড়া লাগাতে।
- প্যাকিং ফয়েল প্রস্তুত করতে।
ধাতুবিদ্যা সহায়িকা (Metallurgy Handbook)
ধাতুবিদ্যা হল প্রকৃতিতে প্রাপ্ত উৎস থেকে ধাতু নিষ্কাশনের বিজ্ঞান। যেকোনো নির্দিষ্ট ধাতুর অধ্যয়ন শুরু করার আগে খনিজ, আকরিক এবং নিষ্কাশনের রাসায়নিক নীতিগুলির মতো মৌলিক ধারণাগুলি বোঝা অত্যন্ত গুরুত্বপূর্ণ। এই সহায়িকাটি ধাতুবিদ্যার সেই মূল ভিত্তিগুলি স্পষ্ট করার পাশাপাশি আধুনিক শিল্পে ব্যবহৃত কিছু প্রধান ধাতুর বৈশিষ্ট্য, নিষ্কাশন পদ্ধতি এবং প্রয়োগ সম্পর্কে একটি বিশদ আলোচনা উপস্থাপন করে।
1.0 ধাতুবিদ্যার মূল ভিত্তি (Fundamental Principles of Metallurgy)
ধাতু নিষ্কাশনের ভিত্তি কিছু মৌলিক সংজ্ঞা এবং রাসায়নিক নীতির উপর প্রতিষ্ঠিত। খনিজ ও আকরিকের মধ্যে পার্থক্য, জারণ-বিজারণের ধারণা এবং ধাতুর সক্রিয়তা শ্রেণি কীভাবে নিষ্কাশন পদ্ধতিকে প্রভাবিত করে, তা এই বিভাগে আলোচনা করা হয়েছে।
1.1 খনিজ ও আকরিকের সংজ্ঞা (Defining Minerals and Ores)
ধাতুবিদ্যা আলোচনার শুরুতে ‘খনিজ’ এবং ‘আকরিক’—এই দুটি শব্দের মধ্যে সুস্পষ্ট পার্থক্য বোঝা অপরিহার্য। যদিও উভয়ই প্রকৃতিতে প্রাপ্ত যৌগ, সব খনিজকে আকরিক হিসেবে গণ্য করা হয় না।
|
খনিজ (Mineral) |
আকরিক (Ore) |
|
ভূগর্ভে বা ভূপৃষ্ঠে প্রাপ্ত প্রকৃতিজাত অজৈব পদার্থসমূহ, যাদের মধ্যে এক বা একাধিক ধাতু প্রধানত যৌগরূপে (কখনো কখনো মুক্ত অবস্থায়) অন্যান্য অশুদ্ধির সঙ্গে মিশ্রিত অবস্থায় থাকে, তাদের সংশ্লিষ্ট ধাতুর খনিজ বলে। |
যে সমস্ত খনিজ থেকে সহজে ও লাভজনক উপায়ে উন্নতমানের ধাতু নিষ্কাশন করা যায়, তাকে আকরিক বলে। |
একটি উৎকৃষ্ট উদাহরণ হল আয়রনের দুটি খনিজ: রেড হেমাটাইট (Fe₂O₃) এবং আয়রন পাইরাইটিস (FeS₂)। রেড হেমাটাইট থেকে সহজে এবং অর্থনৈতিকভাবে লাভজনক উপায়ে আয়রন নিষ্কাশন করা সম্ভব, তাই এটি আয়রনের একটি আকরিক। অন্যদিকে, আয়রন পাইরাইটিস থেকে আয়রন নিষ্কাশন করা জটিল এবং ব্যয়বহুল হওয়ায় এটি আয়রনের একটি খনিজ মাত্র, আকরিক নয়।
1.2 জারণ ও বিজারণের ধারণা (Concepts of Oxidation and Reduction)
ধাতু নিষ্কাশনের প্রায় প্রতিটি ধাপ জারণ ও বিজারণ প্রক্রিয়ার উপর নির্ভরশীল। ইলেকট্রনীয় তত্ত্ব অনুসারে এদের সংজ্ঞা নিম্নরূপ:
- জারণ (Oxidation): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে, তাকে জারণ বলে।
- উদাহরণ (i):
Na → Na⁺ + e - উদাহরণ (ii):
Ca → Ca²⁺ + 2e - উদাহরণ (iii):
Fe²⁺ → Fe³⁺ + e
- উদাহরণ (i):
- বিজারণ (Reduction): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে, তাকে বিজারণ বলে।
- উদাহরণ (i):
Cl + e → Cl⁻ - উদাহরণ (ii):
O + 2e → O²⁻
- উদাহরণ (i):
1.3 নিষ্কাশনের নীতি: ধাতুর সক্রিয়তা শ্রেণি (Principle of Extraction: The Metal Activity Series)
আকরিক থেকে ধাতু নিষ্কাশন প্রক্রিয়াটি মূলত একটি বিজারণ বিক্রিয়া। কোন ধাতুর জন্য কোন বিজারণ পদ্ধতি ব্যবহার করা হবে, তা মূলত ধাতুর সক্রিয়তা শ্রেণিতে ওই ধাতুর অবস্থানের উপর নির্ভর করে।
ধাতুর সক্রিয়তা শ্রেণি হল এমন একটি সারি যেখানে ধাতুগুলিকে তাদের রাসায়নিক সক্রিয়তা অনুসারে ক্রমান্বয়ে সাজানো হয়। এই শ্রেণিবিভাগ নিষ্কাশন পদ্ধতির একটি সাধারণ রূপরেখা প্রদান করে।
|
ধাতুসমূহ (Metals) |
সক্রিয়তা স্তর (Activity Level) |
নিষ্কাশন পদ্ধতির বিশ্লেষণ (Analysis of Extraction Method) |
|
K, Ca, Na, Mg, Al |
সর্বাধিক সক্রিয় |
এদের অক্সাইড হাইড্রোজেন বা কার্বন দ্বারা বিজারিত হয় না। এই সমস্ত ধাতুর গলিত ক্লোরাইড বা হাইড্রক্সাইড লবণের তড়িৎ বিশ্লেষণ করে ধাতু নিষ্কাশন করা হয়। |
|
Zn, Fe, Sn, Pb, H, Cu |
মাঝারি সক্রিয় |
এদের বিভিন্ন আকরিকগুলিকে প্রথমে অক্সাইডে পরিণত করা হয় এবং তারপর উচ্চ উষ্ণতায় বিজারিত করে ধাতু নিষ্কাশন করা হয়। |
|
Hg, Ag, Au |
সর্বনিম্ন সক্রিয় |
এরা অত্যন্ত কম সক্রিয় হওয়ায় এদের অক্সাইডগুলিকে শুধুমাত্র উত্তপ্ত করলেই ধাতু নিষ্কাশন করা সম্ভব হয়। |
এই মৌলিক নীতিগুলি বোঝার পর, আমরা এখন কিছু গুরুত্বপূর্ণ শিল্পজাত ধাতুর সুনির্দিষ্ট বৈশিষ্ট্য এবং প্রয়োগগুলি খতিয়ে দেখতে প্রস্তুত।
2.0 প্রধান শিল্পজাত ধাতু: বৈশিষ্ট্য ও প্রয়োগ (Key Industrial Metals: Properties and Applications)
আধুনিক শিল্প ও প্রযুক্তির ভিত্তি গড়ে উঠেছে আয়রন, কপার, জিঙ্ক এবং অ্যালুমিনিয়ামের মতো কয়েকটি অপরিহার্য ধাতুর উপর। এদের অনন্য বৈশিষ্ট্য এবং বহুমুখী প্রয়োগ এদেরকে অর্থনৈতিকভাবে অত্যন্ত গুরুত্বপূর্ণ করে তুলেছে। এই বিভাগে প্রতিটি ধাতুর প্রকারভেদ, নিষ্কাশন পদ্ধতির বিশেষত্ব এবং প্রধান ব্যবহারিক ক্ষেত্রগুলির উপর আলোকপাত করা হয়েছে।
2.1 আয়রন (Iron / লোহা)
আয়রন বা লোহা সবচেয়ে বহুল ব্যবহৃত ধাতুগুলির মধ্যে অন্যতম। কার্বনের পরিমাণের উপর ভিত্তি করে এর বৈশিষ্ট্য এবং প্রয়োগের ভিন্নতা দেখা যায়।
2.1.1 কার্বনের পরিমাণের ভিত্তিতে প্রকারভেদ (Classification based on Carbon Content)
|
শ্রেণি (Grade) |
বাংলা নাম (Bengali Name) |
কার্বনের পরিমাণ (Carbon Content %) |
|
Cast Iron |
ঢালাই লোহা |
2 – 4.5% |
|
Wrought Iron |
পেটা লোহা |
0.1 – 0.15% |
|
Steel |
ইস্পাত |
0.15 – 1.5% |
2.1.2 থার্মিট পদ্ধতিতে নিষ্কাশন (Extraction via Thermite Process)
থার্মিট পদ্ধতি একটি বিশেষ বিজারণ প্রক্রিয়া যা উচ্চ তাপমাত্রা উৎপন্ন করে এবং গলিত আয়রন তৈরি করতে ব্যবহৃত হয়, যা প্রায়শই ভাঙা রেললাইন জোড়া লাগানোর মতো কাজে লাগে।
- থার্মিট মিশ্রণ: ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) এবং ১ ভাগ অ্যালুমিনিয়াম (Al) চূর্ণের মিশ্রণকে থার্মিট মিশ্রণ বলা হয়।
- প্রক্রিয়া: উচ্চ উষ্ণতায় এই মিশ্রণে থাকা অ্যালুমিনিয়াম, ফেরিক অক্সাইডকে বিজারিত করে গলিত আয়রন এবং অ্যালুমিনিয়াম অক্সাইড উৎপন্ন করে।
- রাসায়নিক বিক্রিয়া:
Fe₂O₃ + 2Al → 2Fe (গলিত) + Al₂O₃
2.2 কপার (Copper / তামা)
কপার বা তামা এর উচ্চ তড়িৎ পরিবাহিতার জন্য বিশেষভাবে পরিচিত এবং এটি বৈদ্যুতিক শিল্পে অপরিহার্য।
2.2.1 ব্যবহারিক প্রয়োগ (Practical Applications)
- টেলিফোনের তার এবং বৈদ্যুতিক ওয়্যারিং-এর কাজে।
- তড়িৎকোশে তড়িৎদ্বাররূপে এবং তড়িৎ-লেপনের কাজে।
- মোটর, ট্রান্সফর্মার, ডায়নামো প্রভৃতি বৈদ্যুতিক যন্ত্র তৈরিতে।
- বয়লার এবং ক্যালোরিমিটারের মতো তাপীয় যন্ত্র তৈরিতে।
2.3 জিঙ্ক (Zinc / দস্তা)
জিঙ্ক বা দস্তা একটি গুরুত্বপূর্ণ ধাতু যা মূলত অন্য ধাতুকে ক্ষয়ের হাত থেকে রক্ষা করতে এবং বিভিন্ন রাসায়নিক প্রয়োগে ব্যবহৃত হয়।
2.3.1 কার্বন-বিজারণ পদ্ধতিতে নিষ্কাশন (Extraction via Carbon-Reduction)
জিঙ্ক ব্লেন্ড (ZnS) আকরিক থেকে জিঙ্ক নিষ্কাশনের জন্য কার্বন-বিজারণ পদ্ধতি অনুসরণ করা হয়। প্রথমে জিঙ্ক ব্লেন্ডকে নিয়ন্ত্রিত বায়ুপ্রবাহে জারিত করে জিঙ্ক অক্সাইডে (ZnO) পরিণত করা হয়। এরপর প্রাপ্ত ZnO-এর সঙ্গে কোক চূর্ণ মিশিয়ে প্রায় ১৩০০°-১৪০০°C উষ্ণতায় উত্তপ্ত করলে এটি বিজারিত হয়ে ধাতব জিঙ্কে পরিণত হয়।
- বিজারণ বিক্রিয়া:
ZnO + C → Zn + CO↑
2.3.2 ব্যবহারিক প্রয়োগ (Practical Applications)
- পরীক্ষাগারে হাইড্রোজেন গ্যাস প্রস্তুতিতে।
- জিঙ্ক হোয়াইট নামক সাদা রঙ প্রস্তুতিতে।
- শুকনো বা নির্জল কোষ (Dry Cell) তৈরিতে।
- লোহাকে মরিচার হাত থেকে রক্ষা করার জন্য গ্যালভানাইজেশন প্রক্রিয়ায়।
2.4 অ্যালুমিনিয়াম (Aluminum)
অ্যালুমিনিয়াম তার হালকা ওজন, দৃঢ়তা এবং ক্ষয়-প্রতিরোধী ক্ষমতার জন্য বিমান ও স্বয়ংচালিত শিল্পে ব্যাপকভাবে ব্যবহৃত হয়।
2.4.1 ব্যবহারিক প্রয়োগ (Practical Applications)
- বিমান এবং মোটরগাড়ির কাঠামো তৈরিতে।
- বৈদ্যুতিক তার প্রস্তুতিতে।
- রান্নার বাসনপত্র তৈরিতে।
- থার্মিট পদ্ধতিতে বিজারক হিসেবে।
- খাবার ও অন্যান্য সামগ্রী মোড়ানোর জন্য প্যাকিং ফয়েল প্রস্তুতিতে।
এই ধাতুগুলির স্বতন্ত্র বৈশিষ্ট্যগুলি অত্যন্ত কার্যকর হলেও, নির্দিষ্ট প্রয়োজন মেটাতে প্রায়শই একাধিক ধাতুকে একত্রিত করে আরও উন্নত বৈশিষ্ট্যসম্পন্ন ধাতু-সংকর তৈরি করা হয়।
3.0 ধাতু-সংকর: গঠন ও উদ্দেশ্য (Alloys: Composition and Purpose)
বিশুদ্ধ ধাতুর নির্দিষ্ট কিছু সীমাবদ্ধতা অতিক্রম করার জন্য ধাতু-সংকর তৈরি করা হয়। দুই বা ততোধিক ধাতুর মিশ্রণের মাধ্যমে এমন একটি নতুন উপাদান তৈরি করা হয়, যার বৈশিষ্ট্যগুলি তার মূল উপাদানগুলির চেয়ে উন্নততর, যেমন—অধিকতর শক্তি, কাঠিন্য বা ক্ষয়-প্রতিরোধ ক্ষমতা।
3.1 ধাতু-সংকরের সংজ্ঞা ও উদাহরণ (Definition and Examples of Alloys)
ধাতু-সংকর হল দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণে উৎপন্ন কঠিন দ্রবণ। কিছু ক্ষেত্রে, ধাতু-সংকরে অধাতুও উপস্থিত থাকতে পারে।
এর একটি প্রধান উদাহরণ হলো ইস্পাত (Steel)। যদিও এটিকে প্রায়শই আয়রনের একটি প্রকারভেদ হিসেবে উল্লেখ করা হয়, প্রযুক্তিগতভাবে ইস্পাত হল আয়রন এবং কার্বনের একটি ধাতু-সংকর, যা বিশুদ্ধ আয়রনের চেয়ে অনেক বেশি শক্তিশালী এবং বহুমুখী।
উন্নত উপাদান তৈরির পাশাপাশি, বিদ্যমান ধাতব কাঠামোকে পরিবেশগত অবক্ষয় থেকে রক্ষা করাও ধাতুবিদ্যার একটি গুরুত্বপূর্ণ দিক।
4.0 লোহার ক্ষয় (মরিচা) এবং প্রতিরোধ (Corrosion of Iron (Rust) and its Prevention)
ধাতুর ক্ষয়, বিশেষ করে লোহা বা ইস্পাতের উপর মরিচা পড়া, একটি গুরুতর সমস্যা যা পরিকাঠামোর স্থায়িত্ব কমিয়ে দেয় এবং অর্থনৈতিক ক্ষতিসাধন করে। মরিচা পড়ার শর্তাবলী এবং কারণগুলি বুঝতে পারলে এর কার্যকর প্রতিরোধের উপায় বের করা সম্ভব হয়।
4.1 মরিচা: সংজ্ঞা ও শর্তাবলী (Rust: Definition and Conditions)
লোহা বা লোহাজাত দ্রব্যকে আর্দ্র বায়ুতে খোলা অবস্থায় রেখে দিলে এর উপর যে লালচে-বাদামী বর্ণের আস্তরণ পড়ে, তাকে মরিচা (Rust) বলে।
- রাসায়নিক সংকেত: মরিচার প্রধান উপাদান হলো সোদক ফেরিক অক্সাইড, যার সাধারণ সংকেত
Fe₂O₃ . xH₂O। - প্রয়োজনীয় শর্তাবলী: মরিচা পড়ার জন্য দুটি শর্ত অপরিহার্য:
- অক্সিজেনের উপস্থিতি।
- জল বা জলীয় বাষ্পের উপস্থিতি।
4.2 মরিচা পড়ার হার ত্বরান্বিতকারী কারণসমূহ (Factors Accelerating Rusting)
কিছু পরিবেশগত কারণ মরিচা পড়ার প্রক্রিয়াকে ত্বরান্বিত করে:
- আয়নিক পদার্থের উপস্থিতি: বাতাসে বা জলে ক্লোরাইড (Cl⁻) বা সালফেট (SO₄²⁻) এর মতো আধানযুক্ত কণার উপস্থিতি মরিচা গঠন প্রক্রিয়াকে দ্রুততর করে।
- আর্দ্রতা ও তাপমাত্রা: বাতাসে জলীয় বাষ্পের পরিমাণ বৃদ্ধি পেলে বা উষ্ণতা বাড়লে মরিচা পড়ার হার বৃদ্ধি পায়।
4.3 প্রতিরোধের কৌশল (Prevention Strategies)
মরিচা প্রতিরোধ করার জন্য বিভিন্ন কার্যকরী কৌশল অবলম্বন করা হয়, যা মূলত লোহাকে বাতাস এবং জলের সংস্পর্শ থেকে দূরে রাখার উপর কেন্দ্র করে তৈরি।
- প্রলেপন: লোহার বস্তুর উপর আলকাতরা, রঙ বা বার্নিশের মতো প্রতিরক্ষামূলক আস্তরণ প্রয়োগ করে এটিকে বাতাস ও জল থেকে বিচ্ছিন্ন রাখা হয়।
- ফেরোসোফেরিক অক্সাইড স্তর গঠন: লোহিততপ্ত লোহার উপর দিয়ে স্টিম চালনা করলে এর পৃষ্ঠতলে ফেরোসোফেরিক অক্সাইডের একটি স্থায়ী আস্তরণ তৈরি হয়, যা মরিচা প্রতিরোধ করে।
- গ্যালভানাইজেশন (Galvanization): লোহার উপর গলিত জিঙ্কের প্রলেপ দেওয়ার প্রক্রিয়াকে গ্যালভানাইজেশন বলে। জিঙ্কের স্তরটি লোহার আগে ক্ষয়প্রাপ্ত হয়ে মূল ধাতুকে রক্ষা করে।
- স্যাক্রিফিশিয়াল প্রোটেকশন (Sacrificial Protection): লোহা বা ইস্পাতের কাঠামোকে এর চেয়ে বেশি সক্রিয় ধাতু, যেমন ম্যাগনেসিয়াম (Mg) ব্লকের সাথে একটি পরিবাহী তার দ্বারা সংযুক্ত করা হয়। এক্ষেত্রে ম্যাগনেসিয়াম নিজে জারিত হয়ে লোহার ক্ষয় প্রতিরোধ করে।
ধাতুবিদ্যা: খনিজ থেকে ধাতু নিষ্কাশন ও ব্যবহার
1. সূচনা: খনিজ ও আকরিক
ধাতুবিদ্যা হল বিজ্ঞানের সেই শাখা যেখানে আকরিক থেকে ধাতু নিষ্কাশন, বিশুদ্ধিকরণ এবং বিভিন্ন ক্ষেত্রে তাদের ব্যবহার নিয়ে আলোচনা করা হয়।
খনিজ (Mineral)
ভূগর্ভে বা ভূপৃষ্ঠে প্রাপ্ত প্রাকৃতিক অজৈব পদার্থ, যাদের মধ্যে এক বা একাধিক ধাতু প্রধানত যৌগরূপে (কখনো কখনো মুক্ত অবস্থায়) অন্যান্য অপদ্রব্যের সাথে মিশ্রিত অবস্থায় থাকে, তাদের ওই ধাতুর খনিজ বলা হয়। উদাহরণস্বরূপ, রেড হিমাটাইট (Fe₂O₃) এবং আয়রন পাইরাইটস (FeS₂) উভয়ই লোহার খনিজ।
আকরিক (Ore)
যেসব খনিজ থেকে সহজে ও লাভজনকভাবে উন্নত মানের ধাতু নিষ্কাশন করা যায়, তাদের সেই ধাতুর আকরিক বলা হয়। যেমন, রেড হিমাটাইট থেকে লাভজনকভাবে লোহা নিষ্কাশন করা যায় বলে এটি লোহার একটি আকরিক।
এই প্রসঙ্গে একটি গুরুত্বপূর্ণ ধারণা মনে রাখা প্রয়োজন: সব আকরিকই খনিজ, কিন্তু সব খনিজ আকরিক নয়।
উদাহরণস্বরূপ, রেড হিমাটাইট (Fe₂O₃) এবং আয়রন পাইরাইটস (FeS₂) দুটোই লোহার খনিজ। কিন্তু শুধুমাত্র রেড হিমাটাইট থেকেই সহজে ও লাভজনকভাবে লোহা নিষ্কাশন করা যায়, তাই এটি আকরিক। অন্যদিকে, আয়রন পাইরাইটস থেকে লোহা নিষ্কাশন জটিল ও ব্যয়বহুল হওয়ায় এটিকে খনিজ বলা হলেও আকরিক বলা হয় না।
কিন্তু কীভাবে এই আকরিক থেকে ধাতু বের করা হয়? এর পেছনে রয়েছে দুটি মৌলিক রাসায়নিক প্রক্রিয়া—জারণ ও বিজারণ।
2. ধাতু নিষ্কাশনের মূল ভিত্তি: জারণ ও বিজারণ
ইলেকট্রনীয় তত্ত্ব অনুসারে, জারণ ও বিজারণ প্রক্রিয়া দুটিকে নিম্নরূপে ব্যাখ্যা করা যায়:
জারণ (Oxidation)
যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে, তাকে জারণ বলে।
Na → Na⁺ + e⁻(সোডিয়াম পরমাণু একটি ইলেকট্রন বর্জন করে সোডিয়াম আয়নে জারিত হয়)Fe²⁺ → Fe³⁺ + e⁻(ফেরাস আয়ন একটি ইলেকট্রন বর্জন করে ফেরিক আয়নে জারিত হয়)
বিজারণ (Reduction)
যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে, তাকে বিজারণ বলে।
Cl + e⁻ → Cl⁻(ক্লোরিন পরমাণু একটি ইলেকট্রন গ্রহণ করে ক্লোরাইড আয়নে বিজারিত হয়)O + 2e⁻ → O²⁻(অক্সিজেন পরমাণু দুটি ইলেকট্রন গ্রহণ করে অক্সাইড আয়নে বিজারিত হয়)
আকরিক অবস্থায় ধাতুগুলি সাধারণত জারিত অবস্থায় (আয়ন হিসেবে) থাকে। তাই, ধাতুর আকরিক থেকে ধাতু নিষ্কাশন মূলত একটি বিজারণ প্রক্রিয়া। এই প্রক্রিয়ায় ধাতব আয়ন ইলেকট্রন গ্রহণ করে ধাতব পরমাণুতে পরিণত হয়।
কিন্তু কোন ধাতুর জন্য কোন বিজারণ পদ্ধতি ব্যবহার করা হবে, তা কীভাবে ঠিক করা হয়? এর উত্তর লুকিয়ে আছে ধাতুর সক্রিয়তা শ্রেণিতে।
3. ধাতুদের শক্তি পরীক্ষা: সক্রিয়তা শ্রেণি
ধাতুর সক্রিয়তা শ্রেণি বা তড়িৎ-রাসায়নিক শ্রেণি হলো এমন একটি তালিকা যেখানে ধাতুগুলিকে তাদের রাসায়নিক সক্রিয়তা অনুসারে ওপর থেকে নিচে ক্রমান্বয়ে হ্রাস অনুযায়ী সাজানো হয়। এই শ্রেণিই নির্ধারণ করে দেয় কোন ধাতুকে তার আকরিক থেকে নিষ্কাশন করতে কোন পদ্ধতি অবলম্বন করতে হবে।
|
ধাতুর অবস্থান (Position of Metals) |
সক্রিয়তা (Activity) |
নিষ্কাশন পদ্ধতির মূলনীতি (Principle of Extraction Method) |
|
K, Ca, Na, Mg, Al |
অত্যন্ত সক্রিয় |
এদের অক্সাইডকে কার্বন বা হাইড্রোজেন দ্বারা বিজারিত করা যায় না। তাই এদের গলিত ক্লোরাইড বা হাইড্রক্সাইড লবণের তড়িৎ-বিশ্লেষণ করে ধাতু নিষ্কাশন করা হয়। |
|
Zn, Fe, Sn, Pb, H, Cu |
মাঝারি সক্রিয় |
এদের আকরিককে প্রথমে অক্সাইডে পরিণত করা হয়। এরপর উচ্চ উষ্ণতায় কার্বন (কোক) দ্বারা বিজারণ ঘটিয়ে ধাতু নিষ্কাশন করা হয়। |
|
Hg, Ag, Au |
খুব কম সক্রিয় |
এরা খুবই কম সক্রিয় হওয়ায় এদের অক্সাইডকে শুধুমাত্র উত্তপ্ত করলেই বিয়োজিত হয়ে ধাতু উৎপন্ন হয়। |
এবার কয়েকটি নির্দিষ্ট উদাহরণ দিয়ে দেখা যাক, এই শ্রেণি অনুযায়ী কীভাবে বিভিন্ন ধাতু নিষ্কাশন করা হয়।
4. পদ্ধতিগত আলোচনা: নির্দিষ্ট ধাতু নিষ্কাশন
সোডিয়াম (Na) নিষ্কাশন
সোডিয়াম অত্যন্ত সক্রিয় ধাতু হওয়ায় এর গলিত লবণ সোডিয়াম ক্লোরাইড (NaCl)-এর তড়িৎ-বিশ্লেষণ করা হয়। একটি পাত্রে আয়রন ক্যাথোড ও গ্রাফাইট অ্যানোড ব্যবহার করে গলিত NaCl-এর মধ্যে দিয়ে তড়িৎ চালনা করলে ক্যাথোডে সোডিয়াম ধাতু জমা হয়।
- বিয়োজন:
NaCl → Na⁺ + Cl⁻ - ক্যাথোড বিক্রিয়া:
Na⁺ + e⁻ → Na(বিজারণ) - অ্যানোড বিক্রিয়া:
2Cl⁻ → Cl₂ + 2e⁻(জারণ)
জিংক (Zn) নিষ্কাশন
জিংক মাঝারি সক্রিয় ধাতু। এর প্রধান আকরিক জিঙ্ক ব্লেন্ড (ZnS)-কে প্রথমে নিয়ন্ত্রিত বায়ুপ্রবাহে উত্তপ্ত করে জিঙ্ক অক্সাইডে (ZnO) পরিণত করা হয়। এরপর প্রাপ্ত ZnO-এর সাথে কোক চূর্ণ (কার্বন) মিশিয়ে প্রায় ১৩০০°-১৪০০°C উষ্ণতায় উত্তপ্ত করলে কার্বন-বিজারণ ঘটে এবং জিংক ধাতু পাওয়া যায়।
- বিক্রিয়া:
ZnO + C → Zn + CO↑
আয়রন (Fe) নিষ্কাশন (থার্মিট পদ্ধতি)
এই পদ্ধতিতে অ্যালুমিনিয়াম দ্বারা আয়রন (III) অক্সাইডকে বিজারিত করা হয়।
- থার্মিট মিশ্রণ: ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) এবং ১ ভাগ অ্যালুমিনিয়াম (Al) চূর্ণের মিশ্রণকে থার্মিট মিশ্রণ বলে।
- মূলনীতি: উচ্চ উষ্ণতায় অ্যালুমিনিয়াম, ফেরিক অক্সাইডকে বিজারিত করে গলিত আয়রন উৎপন্ন করে। এই বিক্রিয়াটি অত্যন্ত তাপ উৎপাদক হওয়ায় লোহা গলিত অবস্থায় পাওয়া যায়। ভাঙা রেললাইন জোড়া লাগানোর কাজে এর ব্যাপক ব্যবহার রয়েছে।
- বিক্রিয়া:
Fe₂O₃ + 2Al → 2Fe + Al₂O₃ + তাপ
ধাতু নিষ্কাশনের পর একটি বড় সমস্যা হলো বাইরের পরিবেশে ধাতুর ক্ষয়, যার সবচেয়ে পরিচিত উদাহরণ হলো মরচে।
5. ধাতুর ক্ষয়: মরচে প্রতিরোধ
লোহা বা লোহাজাত দ্রব্যকে আর্দ্র বায়ুতে খোলা অবস্থায় রেখে দিলে এর ওপর একটি লালচে-বাদামি আস্তরণ পড়ে, একে মরচে (Rust) বলে। মরচের প্রধান উপাদান হলো শোদক ফেরিক অক্সাইড (Fe₂O₃ . xH₂O)। মরচে পড়ার ফলে ধাতুটি ধীরে ধীরে ক্ষয়প্রাপ্ত হয়।
- মরচে পড়ার প্রধান শর্ত:
- অক্সিজেনের উপস্থিতি
- জল বা জলীয় বাষ্পের উপস্থিতি
- মরচে পড়ার হার ত্বরান্বিত হওয়ার কারণ:
- আধানযুক্ত কণার (যেমন: Cl⁻, SO₄²⁻) উপস্থিতি।
- বায়ুতে জলীয় বাষ্পের পরিমাণ বা উষ্ণতা বৃদ্ধি।
মরচে নিবারণের উপায়
- প্রলেপ দেওয়া: লোহার বস্তুর ওপর রং, আলকাতরা বা বার্নিশের প্রলেপ দিলে তা জল ও বায়ুর সংস্পর্শে আসতে পারে না।
- ফেরোসোফেরিক অক্সাইডের স্তর তৈরি: লোহিততপ্ত আয়রনের ওপর দিয়ে স্টিম চালনা করলে এর পৃষ্ঠতলে ফেরোসোফেরিক অক্সাইডের একটি মজবুত আস্তরণ তৈরি হয়, যা মরচে প্রতিরোধ করে।
- গ্যালভানাইজেশন: লোহার ওপর গলিত জিংকের প্রলেপ দেওয়াকে গ্যালভানাইজেশন বলে। লোহা অপেক্ষা জিংক বেশি সক্রিয় হওয়ায় এটি আগে ক্ষয়প্রাপ্ত হয়ে লোহাকে সুরক্ষিত রাখে।
- ম্যাগনেসিয়াম ব্লক ব্যবহার: লোহা বা জাহাজের স্টিলের কাঠামোর সাথে ম্যাগনেসিয়ামের ব্লক জুড়ে দেওয়া হয়। ম্যাগনেসিয়াম বেশি সক্রিয় হওয়ায় এটি নিজে জারিত হয়ে ক্ষয়প্রাপ্ত হয় এবং লোহাকে মরচের হাত থেকে রক্ষা করে।
ধাতুকে ক্ষয় থেকে বাঁচানোর পাশাপাশি, একাধিক ধাতুকে মিশিয়ে আরও উন্নত পদার্থ তৈরি করা হয়, যা ধাতু-সংকর নামে পরিচিত।
6. ধাতুবিদ্যার প্রয়োগ: ধাতু-সংকর ও ব্যবহারিক গুরুত্ব
ধাতু-সংকর (Alloy) হলো দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণ দ্বারা উৎপন্ন কঠিন দ্রবণ। ধাতু-সংকরে অধাতুও থাকতে পারে, যেমন—ইস্পাত (স্টিল) হলো লোহা ও কার্বনের একটি সংকর।
বিভিন্ন ধাতুর ব্যবহার
- কপার বা তামা (Cu):
- বৈদ্যুতিক তার (টেলিফোন, ওয়্যারিং) নির্মাণে।
- তড়িৎকোষে তড়িৎদ্বার রূপে ও তড়িৎ-লেপনের কাজে।
- বৈদ্যুতিক যন্ত্র (মোটর, ডায়নামো, ট্রান্সফর্মার) তৈরিতে।
- বয়লার ও ক্যালরিমিটার তৈরিতে।
- জিংক বা দস্তা (Zn):
- গ্যালভানাইজেশন প্রক্রিয়ায় লোহার ওপর প্রলেপ দিতে।
- নির্জল কোষ বা ড্রাই সেল তৈরিতে।
- পরীক্ষাগারে হাইড্রোজেন গ্যাস প্রস্তুতিতে।
- জিংক হোয়াইট নামক সাদা রং তৈরিতে।
- অ্যালুমিনিয়াম (Al):
- বিমান ও মোটরগাড়ির কাঠামো তৈরিতে।
- বৈদ্যুতিক তার নির্মাণে।
- রান্নার বাসনপত্র তৈরিতে।
- খাবার বা ঔষধপত্র মোড়ানোর জন্য প্যাকিং ফয়েল তৈরিতে।
- থার্মিট পদ্ধতিতে রেললাইন জোড়া লাগানোর কাজে।
আয়রনের প্রকারভেদ
আয়রনে উপস্থিত কার্বনের পরিমাণের ওপর ভিত্তি করে একে প্রধানত তিনটি ভাগে ভাগ করা হয়:
- কাস্ট আয়রন (ঢালাই লোহা): কার্বনের পরিমাণ ২% – ৪.৫%
- রট আয়রন (পেটা লোহা): কার্বনের পরিমাণ ০.১% – ০.১৫%
- স্টিল (ইস্পাত): কার্বনের পরিমাণ ০.১৫% – ১.৫%
দশম শ্রেণী ভৌত বিজ্ঞান: ধাতুবিদ্যা স্টাডি গাইড
অধ্যায়ের সারসংক্ষেপ ও বিশ্লেষণ
এই নির্দেশিকাটি ধাতুবিদ্যার মূল ধারণাগুলি বোঝার জন্য তৈরি করা হয়েছে। এখানে খনিজ ও আকরিকের মধ্যে পার্থক্য, জারণ ও বিজারণের ইলেকট্রনীয় তত্ত্ব এবং ধাতুর সক্রিয়তা শ্রেণির উপর ভিত্তি করে ধাতু নিষ্কাশনের বিভিন্ন নীতি আলোচনা করা হয়েছে। অধিক সক্রিয়, মাঝারি সক্রিয় এবং কম সক্রিয় ধাতু নিষ্কাশনের ভিন্ন ভিন্ন পদ্ধতি, যেমন—তড়িৎবিশ্লেষণ, কার্বন-বিজারণ এবং তাপীয় বিজারণের বিশদ বিবরণ রয়েছে। থার্মিট পদ্ধতি, মরচে পড়ার কারণ ও তার নিবারণের উপায়, বিভিন্ন গুরুত্বপূর্ণ ধাতু ও তাদের ব্যবহার এবং ধাতু-সংকর সম্পর্কেও বিস্তারিত আলোচনা করা হয়েছে।
——————————————————————————–
সংক্ষিপ্ত প্রশ্নোত্তর পর্ব
১. খনিজ ও আকরিকের মধ্যে মূল পার্থক্য উদাহরণসহ ব্যাখ্যা করো।
২. ইলেকট্রনীয় তত্ত্ব অনুসারে জারণ প্রক্রিয়া কাকে বলে? উদাহরণ দাও।
৩. বিজারণ বলতে কী বোঝো? ইলেকট্রনীয় তত্ত্ব অনুসারে উদাহরণসহ ব্যাখ্যা করো।
৪. থার্মিট মিশ্রণ কী? এর রাসায়নিক বিক্রিয়াটি লেখো।
৫. কার্বন-বিজারণ পদ্ধতিতে জিঙ্ক অক্সাইড থেকে কীভাবে জিঙ্ক ধাতু নিষ্কাশন করা হয়?
৬. গলিত সোডিয়াম ক্লোরাইডের তড়িৎবিশ্লেষণে ক্যাথোড ও অ্যানোডে কী কী বিক্রিয়া ঘটে?
৭. মরচে কী? এর প্রধান রাসায়নিক উপাদান ও সংকেত উল্লেখ করো।
৮. গ্যালভানাইজেশন কাকে বলে এবং কেন এটি করা হয়?
৯. ধাতু-সংকর বলতে কী বোঝো? একটি উদাহরণ দাও যেখানে অধাতুও উপস্থিত থাকে।
১০. ধাতুর সক্রিয়তা শ্রেণি কী এবং ধাতু নিষ্কাশনে এর গুরুত্ব কী?
——————————————————————————–
উত্তরমালা
১. ভূগর্ভে প্রাপ্ত প্রকৃতিজাত অজৈব পদার্থ, যাতে এক বা একাধিক ধাতু যৌগরূপে বা মুক্ত অবস্থায় অশুদ্ধির সাথে মিশ্রিত থাকে, তাকে খনিজ বলে। যে সমস্ত খনিজ থেকে সহজে ও লাভজনক উপায়ে উন্নত মানের ধাতু নিষ্কাশন করা যায়, তাদের আকরিক বলা হয়। যেমন, রেড হেমাটাইট (Fe₂O₃) আয়রনের আকরিক, কিন্তু আয়রন পাইরাইটস (FeS₂) শুধুমাত্র খনিজ, আকরিক নয়।
২. যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে, তাকে জারণ বলে। এই প্রক্রিয়ায় পরমাণু বা আয়নের ধনাত্মক চার্জ বৃদ্ধি পায় অথবা ঋণাত্মক চার্জ হ্রাস পায়। উদাহরণ: Na → Na⁺ + e।
৩. যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে, তাকে বিজারণ বলে। এই প্রক্রিয়ায় পরমাণু বা আয়নের ধনাত্মক চার্জ হ্রাস পায় অথবা ঋণাত্মক চার্জ বৃদ্ধি পায়। উদাহরণ: Cl + e → Cl⁻।
৪. ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) এবং ১ ভাগ অ্যালুমিনিয়াম (Al) চূর্ণের মিশ্রণকে থার্মিট মিশ্রণ বলা হয়। উচ্চ উষ্ণতায় এই মিশ্রণে অ্যালুমিনিয়াম দ্বারা ফেরিক অক্সাইড বিজারিত হয়ে গলিত আয়রন উৎপন্ন করে। বিক্রিয়াটি হলো: Fe₂O₃ + 2Al → 2Fe (গলিত) + Al₂O₃।
৫. জিঙ্ক ব্লেন্ড (ZnS) আকরিককে নিয়ন্ত্রিত বায়ুতে জারিত করে প্রথমে জিঙ্ক অক্সাইডে (ZnO) পরিণত করা হয়। এরপর প্রাপ্ত ZnO-এর সাথে কোক চূর্ণ (বিজারক) মিশিয়ে প্রায় ১৩০০°-১৪০০°C উষ্ণতায় উত্তপ্ত করলে জিঙ্ক অক্সাইড ধাতব জিঙ্কে বিজারিত হয়। বিক্রিয়া: ZnO + C → Zn + CO↑।
৬. গলিত NaCl-এর তড়িৎবিশ্লেষণে আয়রন ক্যাথোড ও গ্রাফাইট অ্যানোড ব্যবহৃত হয়। ক্যাথোডে সোডিয়াম আয়ন (Na⁺) ইলেকট্রন গ্রহণ করে সোডিয়াম ধাতুতে পরিণত হয় (Na⁺ + e → Na)। অ্যানোডে ক্লোরাইড আয়ন (Cl⁻) ইলেকট্রন বর্জন করে ক্লোরিন পরমাণু ও পরে ক্লোরিন গ্যাস (Cl₂) উৎপন্ন করে (Cl⁻ → Cl + e; Cl + Cl → Cl₂)।
৭. লোহা বা লৌহজাত দ্রব্যকে আর্দ্র বায়ুতে খোলা অবস্থায় রাখলে তার ওপর যে লালচে-বাদামি বর্ণের আস্তরণ পড়ে, তাকে মরচে বলে। এর কোনো নির্দিষ্ট রাসায়নিক সংযুতি নেই, তবে এর প্রধান উপাদান হলো সোদক ফেরিক অক্সাইড, যার সংকেত Fe₂O₃.xH₂O।
৮. মরচে নিবারণের জন্য আয়রনজাত দ্রব্যের ওপর গলিত জিঙ্কের প্রলেপ দেওয়াকে জিঙ্ক-লেপন বা গ্যালভানাইজেশন বলে। এটি লোহার পৃষ্ঠকে জল ও বায়ুর সংস্পর্শে আসতে বাধা দেয় এবং ক্ষয় থেকে রক্ষা করে।
৯. দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণে উৎপন্ন কঠিন দ্রবণকে ধাতু-সংকর বলে। তবে ধাতু-সংকরে অধাতুও থাকতে পারে, যেমন—ইস্পাতে আয়রনের সাথে কার্বন (অধাতু) মিশ্রিত থাকে।
১০. ধাতুগুলিকে তাদের ক্রমহ্রাসমান রাসায়নিক সক্রিয়তা অনুযায়ী সাজালে যে শ্রেণি বা সারি পাওয়া যায়, তাকে ধাতুর সক্রিয়তা শ্রেণি বলে। এই শ্রেণিতে ধাতুর অবস্থান দেখে বোঝা যায় কোন ধাতু নিষ্কাশনের জন্য কোন বিজারণ পদ্ধতি (যেমন—তড়িৎবিজারণ, কার্বন-বিজারণ বা শুধু উত্তাপ প্রয়োগ) সবচেয়ে উপযুক্ত হবে।
——————————————————————————–
রচনাধর্মী প্রশ্ন
১. ধাতুর সক্রিয়তা শ্রেণির উপর ভিত্তি করে পটাশিয়াম (K), জিঙ্ক (Zn) এবং গোল্ড (Au) নিষ্কাশনের পদ্ধতিগুলির মধ্যে তুলনামূলক আলোচনা করো।
২. মরচে পড়ার শর্তগুলি কী কী? কী কী কারণে মরচে পড়ার হার বৃদ্ধি পেতে পারে? মরচে নিবারণের চারটি ভিন্ন উপায় বিস্তারিতভাবে আলোচনা করো।
৩. অ্যালুমিনিয়ামের প্রধান ব্যবহারগুলি উল্লেখ করো। থার্মিট পদ্ধতিতে এর ভূমিকা কী এবং এই পদ্ধতি কোথায় ব্যবহৃত হয়?
৪. কার্বনের শতাংশের উপর ভিত্তি করে আয়রনের শ্রেণিবিভাগ করো। কপার ও জিঙ্কের দুটি করে গুরুত্বপূর্ণ ব্যবহার লেখো।
৫. “সমস্ত আকরিকই খনিজ, কিন্তু সমস্ত খনিজ আকরিক নয়” — উক্তিটির যথার্থতা উদাহরণসহ ব্যাখ্যা করো। ধাতু নিষ্কাশন যে একটি বিজারণ প্রক্রিয়া, তা যুক্তিসহ প্রতিষ্ঠা করো।
——————————————————————————–
পরিভাষাকোষ (Glossary)
- আকরিক (Ore): যে সমস্ত খনিজ থেকে সহজে ও লাভজনক উপায়ে উন্নত মানের ধাতু নিষ্কাশন করা যায়।
- ইস্পাত (Steel): আয়রন ও কার্বনের একটি ধাতু-সংকর, যেখানে কার্বনের পরিমাণ ০.১৫% থেকে ১.৫% থাকে।
- কার্বন-বিজারণ (Carbon-reduction): কোক বা কার্বন ব্যবহার করে উচ্চ উষ্ণতায় ধাতব অক্সাইডকে বিজারিত করে ধাতু নিষ্কাশন করার পদ্ধতি।
- কাস্ট আয়রন (Cast Iron): ঢালাই লোহা, যেখানে কার্বনের পরিমাণ ২-৪.৫% থাকে।
- খনিজ (Mineral): ভূগর্ভে বা ভূপৃষ্ঠে প্রাপ্ত প্রকৃতিজাত অজৈব পদার্থ, যার মধ্যে এক বা একাধিক ধাতু যৌগরূপে বা মুক্ত অবস্থায় অশুদ্ধির সাথে মিশ্রিত থাকে।
- গ্যালভানাইজেশন (Galvanization): মরচে নিবারণের জন্য লোহার ওপর জিঙ্কের প্রলেপ দেওয়ার পদ্ধতি।
- জারণ (Oxidation): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে।
- তড়িৎবিশ্লেষণ (Electrolysis): গলিত বা দ্রবীভূত তড়িৎবিশ্লেষ্য পদার্থের মধ্যে দিয়ে তড়িৎ চালনা করে পদার্থটির রাসায়নিক বিয়োজন ঘটানোর প্রক্রিয়া।
- থার্মিট মিশ্রণ (Thermite Mixture): ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) ও ১ ভাগ অ্যালুমিনিয়াম (Al) চূর্ণের মিশ্রণ।
- ধাতু-সংকর (Alloy): দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণে উৎপন্ন কঠিন দ্রবণ।
- ধাতুর সক্রিয়তা শ্রেণি (Metal Reactivity Series): ধাতুগুলিকে তাদের ক্রমহ্রাসমান রাসায়নিক সক্রিয়তা অনুযায়ী সাজালে প্রাপ্ত সারি।
- বিজারণ (Reduction): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে।
- মরচে (Rust): আর্দ্র বায়ুর উপস্থিতিতে লোহার ওপর সৃষ্ট লালচে-বাদামি বর্ণের সোদক ফেরিক অক্সাইডের (Fe₂O₃.xH₂O) আস্তরণ।
- রট আয়রন (Wrought Iron): পেটা লোহা, যা আয়রনের সবচেয়ে বিশুদ্ধ রূপ এবং এতে কার্বনের পরিমাণ ০.১-০.১৫% থাকে।
ধাতুবিদ্যা: আকরিক থেকে ধাতু নিষ্কাশনের পদ্ধতি ও মূলনীতি
এই নথিটি শিক্ষার্থীদের জন্য আকরিক থেকে ধাতু নিষ্কাশনের মূলনীতি এবং বিভিন্ন পদ্ধতিগুলিকে একটি যৌক্তিক এবং সুস্পষ্ট কাঠামোর মাধ্যমে ব্যাখ্যা করবে।
1.0 খনিজ ও আকরিকের মূল ধারণা
|
পরিভাষা |
সংজ্ঞা ও মূল বৈশিষ্ট্য |
|
খনিজ |
ভূগর্ভে বা ভূপৃষ্ঠে প্রাকৃতিকভাবে প্রাপ্ত অজৈব পদার্থ, যার মধ্যে এক বা একাধিক ধাতু যৌগরূপে বা মুক্ত অবস্থায় অশুদ্ধির সাথে মিশ্রিত থাকে। |
|
আকরিক |
যে সমস্ত খনিজ থেকে সহজে এবং লাভজনক উপায়ে উচ্চমানের ধাতু নিষ্কাশন করা সম্ভব, তাদের সেই নির্দিষ্ট ধাতুর আকরিক বলা হয়। |
উদাহরণস্বরূপ, রেড হিমাটাইট (Fe₂O₃) এবং আয়রন পাইরাইটস (FeS₂) উভয়ই আয়রনের খনিজ। কিন্তু শুধুমাত্র রেড হিমাটাইট থেকেই লাভজনকভাবে লোহা নিষ্কাশন করা যায়, তাই এটি লোহার আকরিক। অন্যদিকে, আয়রন পাইরাইটস থেকে লোহা নিষ্কাশন জটিল এবং অলাভজনক হওয়ায় এটি কেবলই একটি খনিজ হিসেবে পরিচিত।
সুতরাং, সকল আকরিকই খনিজ, কিন্তু সকল খনিজ আকরিক নয়। আকরিক চিহ্নিত করার পরেই ধাতু নিষ্কাশনের জন্য উপযুক্ত রাসায়নিক প্রক্রিয়া নির্বাচন করা হয়।
2.0 ধাতু নিষ্কাশনের রাসায়নিক ভিত্তি: জারণ-বিজারণ
আকরিক থেকে ধাতু নিষ্কাশন প্রক্রিয়াটি মৌলিকভাবে একটি রাসায়নিক বিজারণ বিক্রিয়া। এই প্রক্রিয়ার মূল ভিত্তি হলো জারণ ও বিজারণের ধারণা।
- জারণ (Oxidation): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে, তাকে জারণ বলে।
- উদাহরণ:
Na → Na⁺ + e
- উদাহরণ:
- বিজারণ (Reduction): যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে, তাকে বিজারণ বলে।
- উদাহরণ:
Cl + e → Cl⁻
- উদাহরণ:
কোন ধাতুর জন্য কোন বিজারণ পদ্ধতি ব্যবহার করা হবে, তা মূলত ধাতুটির রাসায়নিক সক্রিয়তার উপর নির্ভর করে।
3.0 সক্রিয়তা শ্রেণি: ধাতু নিষ্কাশনের নীলনকশা
ধাতুগুলিকে তাদের ক্রমহ্রাসমান রাসায়নিক সক্রিয়তা অনুযায়ী সাজালে যে শ্রেণি বা সারি পাওয়া যায়, তাকে ধাতুর সক্রিয়তা শ্রেণি বলে। এই শ্রেণিটি ধাতু নিষ্কাশনের জন্য সঠিক পদ্ধতি বেছে নেওয়ার একটি নির্দেশিকা হিসেবে কাজ করে।
|
সক্রিয়তা (Reactivity) |
ধাতুসমূহ (Metals) |
নিষ্কাশন পদ্ধতির মূলনীতি (Principle of Extraction Method) |
|
অত্যধিক সক্রিয় |
K, Ca, Na, Mg, Al |
এদের অক্সাইডকে কার্বন বা হাইড্রোজেন দ্বারা বিজারিত করা যায় না। তাই এই ধাতুগুলিকে তাদের গলিত ক্লোরাইড বা হাইড্রক্সাইড লবণের তড়িৎ বিশ্লেষণ করে নিষ্কাশন করা হয়। |
|
মাঝারি সক্রিয় |
Zn, Fe, Sn, Pb, H, Cu |
এদের আকরিকগুলিকে প্রথমে অক্সাইডে রূপান্তরিত করা হয় এবং তারপর উচ্চ উষ্ণতায় উপযুক্ত বিজারক (যেমন কার্বন) দ্বারা বিজারিত করে ধাতু নিষ্কাশন করা হয়। |
|
কম সক্রিয় |
Hg, Ag, Au |
এদের অক্সাইডগুলি সাধারণত কম স্থিতিশীল হয়। তাই শুধুমাত্র উত্তপ্ত করেই এই ধাতুগুলি নিষ্কাশন করা সম্ভব। |
সুতরাং, সক্রিয়তা শ্রেণিই নির্ধারণ করে দেয় যে একটি ধাতুকে তার আকরিক থেকে মুক্ত করতে ঠিক কতটা রাসায়নিক শক্তির প্রয়োজন হবে এবং কোন পদ্ধতিটি সবচেয়ে কার্যকর হবে।
4.0 বিভিন্ন ধাতুর নিষ্কাশন পদ্ধতি: নির্দিষ্ট উদাহরণ
এখন আমরা সক্রিয়তা শ্রেণির বিভিন্ন অংশের ধাতুর জন্য নির্দিষ্ট নিষ্কাশন পদ্ধতিগুলি আলোচনা করব।
4.1 তড়িৎ বিশ্লেষণ পদ্ধতি (সোডিয়াম নিষ্কাশন)
অত্যধিক সক্রিয় ধাতু, যেমন সোডিয়াম, নিষ্কাশনের জন্য এই পদ্ধতি ব্যবহার করা হয়। এক্ষেত্রে গলিত সোডিয়াম ক্লোরাইড (NaCl)-এর তড়িৎ বিশ্লেষণ করা হয়, যেখানে আয়রনের ক্যাথোড ও গ্রাফাইটের অ্যানোড ব্যবহৃত হয়।
- গলিত NaCl-এর বিয়োজন:
NaCl → Na⁺ + Cl⁻ - ক্যাথোড বিক্রিয়া (বিজারণ):
Na⁺ + e → Na - অ্যানোড বিক্রিয়া (জারণ):
Cl⁻ → Cl + e, Cl + Cl → Cl₂
4.2 কার্বন-বিজারণ পদ্ধতি (জিংক নিষ্কাশন)
মাঝারি সক্রিয় ধাতু, যেমন জিংক, নিষ্কাশনের জন্য কার্বন বিজারণ পদ্ধতি বহুল ব্যবহৃত হয়। প্রক্রিয়াটি দুটি ধাপে সম্পন্ন হয়:
- প্রথমে জিংক ব্লেন্ড (ZnS) আকরিককে নিয়ন্ত্রিত বায়ুতে জারিত করে জিংক অক্সাইডে (ZnO) পরিণত করা হয়।
- প্রাপ্ত ZnO-কে কোক চূর্ণের (কার্বন) সাথে মিশিয়ে প্রায় ১৩০০°-১৪০০°C উষ্ণতায় উত্তপ্ত করলে এটি বিজারিত হয়ে ধাতব জিংকে পরিণত হয়।
- মূল বিজারণ বিক্রিয়া:
ZnO + C → Zn + CO↑
4.3 থার্মিট পদ্ধতি (আয়রন নিষ্কাশন)
এই পদ্ধতিতে অ্যালুমিনিয়ামকে বিজারক হিসেবে ব্যবহার করে আয়রন নিষ্কাশন করা হয়।
- থার্মিট মিশ্রণ: ৩ ভাগ ফেরিক অক্সাইড (Fe₂O₃) এবং ১ ভাগ অ্যালুমিনিয়াম (Al) চূর্ণের মিশ্রণ।
- প্রক্রিয়া: উচ্চ উষ্ণতায় অ্যালুমিনিয়াম, ফেরিক অক্সাইডকে বিজারিত করে গলিত আয়রন উৎপন্ন করে। অ্যালুমিনিয়াম আয়রনের চেয়ে বেশি সক্রিয় হওয়ায় এটি আয়রনকে তার যৌগ থেকে প্রতিস্থাপিত করতে পারে।
- বিক্রিয়া:
Fe₂O₃ + 2Al → 2Fe (গলিত) + Al₂O₃
এই বিক্রিয়ায় উৎপন্ন গলিত লোহা ভাঙা রেললাইন জোড়া লাগানোর মতো কাজে ব্যবহৃত হয়।
ধাতু নিষ্কাশনের পর একটি গুরুত্বপূর্ণ বিষয় হলো সেগুলিকে পরিবেশের ক্ষয় থেকে রক্ষা করা, বিশেষ করে লোহার ক্ষেত্রে মরিচা একটি বড় সমস্যা।
5.0 লোহার মরিচা: কারণ ও প্রতিকার
আর্দ্র বায়ুতে লোহাকে খোলা অবস্থায় রাখলে এর উপর যে লালচে-বাদামি আস্তরণ পড়ে, তাকে মরিচা বলে। এর রাসায়নিক সংকেত হলো Fe₂O₃ . xH₂O (সোদক ফেরিক অক্সাইড)।
মরিচা পড়ার জন্য দুটি শর্ত অপরিহার্য:
- অক্সিজেনের উপস্থিতি
- জল বা জলীয় বাষ্পের উপস্থিতি
মরিচা নিবারণের ৪টি গুরুত্বপূর্ণ উপায় নিচে আলোচনা করা হলো:
- রং বা আলকাতরার প্রলেপ: লোহার তৈরি বস্তুর উপর রং, বার্নিশ বা আলকাতরার প্রলেপ দিলে এটি বায়ু ও জলের সংস্পর্শে আসতে পারে না, ফলে মরিচা ধরে না।
- ফেরোসোফেরিক অক্সাইডের আস্তরণ: লোহিততপ্ত লোহার উপর দিয়ে স্টিম চালনা করলে এর পৃষ্ঠতলে ফেরোসোফেরিক অক্সাইডের একটি স্থায়ী আস্তরণ তৈরি হয়, যা মরিচা প্রতিরোধ করে।
- গ্যালভানাইজেশন (দস্তা-লেপন): লোহার উপর গলিত জিংকের প্রলেপ দেওয়ার প্রক্রিয়াকে গ্যালভানাইজেশন বলে। লোহা অপেক্ষা জিংক বেশি সক্রিয় হওয়ায় এটি আগে জারিত হয় এবং লোহাকে সুরক্ষিত রাখে (একে উৎসর্গীকৃত защита বলা হয়)।
- ম্যাগনেসিয়াম ব্লক ব্যবহার: লোহার কাঠামোর সাথে ম্যাগনেসিয়াম ব্লক যুক্ত করলে, ম্যাগনেসিয়াম অ্যানোড হিসেবে কাজ করে নিজে ক্ষয়প্রাপ্ত হয় এবং লোহার ক্যাথোডকে সুরক্ষিত রাখে।
ধাতুর বৈশিষ্ট্য উন্নত করতে এবং ক্ষয়রোধ করার একটি কার্যকর উপায় হলো ধাতু-সংকর তৈরি করা।
6.0 ধাতু-সংকর ও বিভিন্ন ধাতুর ব্যবহার
দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ত্ব মিশ্রণে উৎপন্ন কঠিন দ্রবণকে ধাতু-সংকর (Alloy) বলে। কিছু ক্ষেত্রে ধাতু-সংকরে অধাতুও থাকতে পারে, যেমন ইস্পাতে লোহার সাথে কার্বন মেশানো থাকে।
বিভিন্ন বিশুদ্ধ ধাতুর ব্যবহার নিচে তালিকাভুক্ত করা হলো:
|
ধাতু (Metal) |
প্রধান ব্যবহার (Key Uses) |
|
তামা (Copper) |
* বৈদ্যুতিক তার, টেলিফোনের তার প্রস্তুতিতে।<br>* মোটর, ডায়নামো, ট্রান্সফর্মার তৈরিতে।<br>* ক্যালোরিমিটার এবং বয়লার নির্মাণে। |
|
দস্তা (Zinc) |
* গ্যালভানাইজেশন পদ্ধতিতে লোহার উপর প্রলেপ দিতে।<br>* পরীক্ষাগারে হাইড্রোজেন গ্যাস প্রস্তুতিতে।<br>* শুষ্ক কোষ বা ব্যাটারি তৈরিতে। |
|
অ্যালুমিনিয়াম (Aluminium) |
* বিমান এবং মোটরগাড়ির কাঠামো তৈরিতে।<br>* বৈদ্যুতিক তার এবং রান্নার বাসনপত্র নির্মাণে।<br>* থার্মিট পদ্ধতিতে রেললাইন জোড়া লাগাতে। |
এই আলোচনা থেকে আমরা শিখলাম কীভাবে প্রকৃতিতে প্রাপ্ত খনিজ থেকে ধাপে ধাপে ধাতু নিষ্কাশন করা হয় এবং সেই ধাতু ও তাদের সংকর আমাদের দৈনন্দিন জীবনে বিভিন্ন গুরুত্বপূর্ণ কাজে ব্যবহৃত হয়।
ধাতুবিদ্যা ও ধাতু নিষ্কাশন সম্পর্কিত বিস্তারিত তথ্য
|
ধাতু বা পদার্থের নাম
|
রাসায়নিক সংকেত বা সংযুতি
|
আকরিক ও খনিজ
|
নিষ্কাশন পদ্ধতি
|
ব্যবহার
|
গুরুত্বপূর্ণ বৈশিষ্ট্য বা ঘটনাপ্রবাহ
|
|
|---|---|---|---|---|---|---|
|
আয়রন (Iron)
|
|
রেড হেমাটাইট
|
থার্মিট পদ্ধতি ()
|
রেললাইন জোড়া লাগানো, যন্ত্রাংশ তৈরি।
|
মরিচা পড়া () একটি ক্ষয়কারী প্রক্রিয়া যা অক্সিজেন ও জলের উপস্থিতিতে ঘটে।
|
|
|
অ্যালুমিনিয়াম (Aluminium)
|
|
বক্সাইট
|
তড়িৎ বিশ্লেষণ পদ্ধতি
|
বিমান ও মোটরগাড়ির কাঠামো, বৈদ্যুতিক তার, রান্নার বাসনপত্র।
|
থার্মিট পদ্ধতিতে বিজারণকারী পদার্থ হিসেবে ব্যবহৃত হয়।
|
|
|
জিঙ্ক (Zinc)
|
(জিঙ্ক ব্লেন্ড), (জিঙ্ক অক্সাইড)
|
জিঙ্ক ব্লেন্ড
|
কার্বন-বিজারণ পদ্ধতি ()
|
গ্যালভানাইজেশন, হাইড্রোজেন প্রস্তুতি, নির্জল কোষ তৈরি।
|
লোহাকে মরিচা থেকে রক্ষা করতে গ্যালভানাইজেশন পদ্ধতিতে দস্তার প্রলেপ দেওয়া হয়।
|
|
|
কপার (Copper)
|
|
কপার পাইরাইটস
|
তাপজারণ ও বিজারণ
|
বৈদ্যুতিক তার, ওয়্যারিং, মোটর, ডায়নামো, ক্যালোরিমিটার।
|
তড়িৎ বিশ্লেষণের মাধ্যমে বিশুদ্ধিকরণ ও তড়িৎ লেপন কাজে ব্যবহৃত হয়।
|
|
|
সোডিয়াম (Sodium)
|
|
খাদ্য লবণ বা হ্যালাইট
|
গলিত লবণের তড়িৎ বিশ্লেষণ পদ্ধতি
|
তড়িৎ কোষে এবং রাসায়নিক শিল্পে।
|
অধিক সক্রিয় ধাতু হওয়ায় গলিত ক্লোরাইড লবণের তড়িৎ বিশ্লেষণের মাধ্যমে নিষ্কাশিত হয়।
|
|
|
ইস্পাত (Steel)
|
(0.15 – 1.5%)
|
Not in source
|
ধাতু-সংকর উৎপাদন
|
নির্মাণ কাজ ও স্থায়ী যন্ত্রপাতি।
|
এটি আয়রনের একটি কার্বনযুক্ত ধাতু-সংকর।
|
![]()